- Ce médicament antiviral a donné des résultats très prometteurs dans un essai randomisé
- L'accord des autorités de santé américaines permet la prescription de ce traitement à l'hôpital pour les cas graves de Covid-19
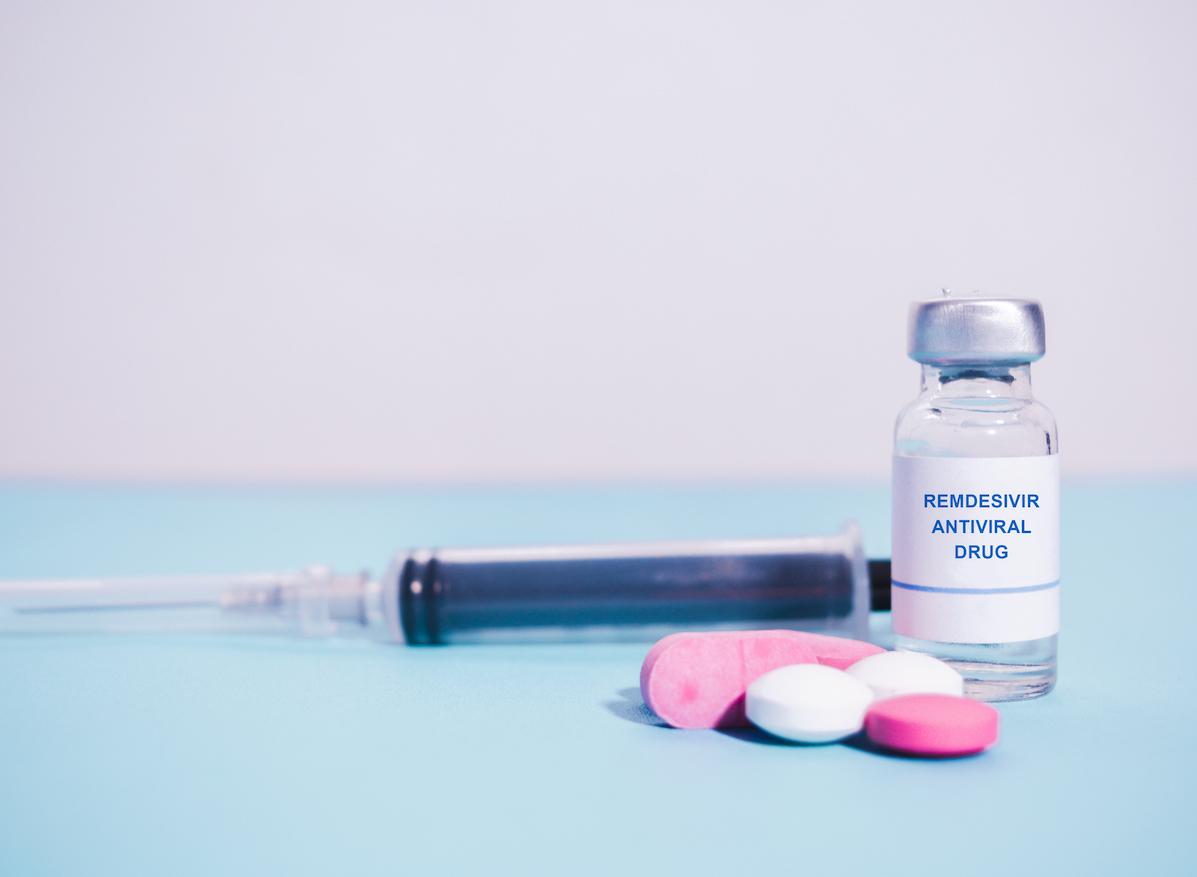
L'Agence américaine du médicament (FDA) a donné son feu vert pour l’utilisation en urgence de l’antiviral expérimental remdésivir. L'autorisation permet au remdésivir, développé durant l'épidémie Ebola en 2014, d'être utilisé par les hôpitaux pour les malades graves du Covid-19 qui ont besoin d'oxygène, par exemple sous respirateurs artificiels, sans avoir besoin de participer à un essai clinique. “Il est raisonnable de penser que le remdésivir puisse être efficace contre le Covid-19 et que, étant donné qu'il n'existe pas de traitements alternatifs adéquats, approuvés ou disponibles, les avantages connus et potentiels pour traiter ce virus sévère et mortel sont supérieurs aux risques connus et potentiels posés par l'utilisation du médicament”, souligne la FDA.
Un traitement développé contre Ebola
Le remdésivir est un antiviral qui a été développé à l'origine contre le virus Ebola. “C’est une prodrogue et un analogue des inhibiteurs nucléotidiques des ARN polymérases, l’enzyme essentielle à la réplication du SARS-CoV-2, virus contre lequel le remdésivir a démontré une activité in vitro”, a précise le docteur Jean-Paul Marre pour Pourquoi docteur. Ce traitement a montré une activité dans d'autres infections à coronavirus comme le syndrome respiratoire aigu sévère (SRAS), le syndrome respiratoire du Moyen-Orient (MERS) et contre le SARS-CoV-2 dans des études sur les animaux.
En France, son utilisation n'en est encore qu'à la phase de test. “Cette molécule est utilisée dans trois essais cliniques. Nous allons étudier les résultats préliminaires puis les résultats publiés pour savoir si on a des données sur l'efficacité”, a déclaré Jérôme Salomon, le directeur général de la Santé. Aux États-Unis, le traitement sera distribué en priorité aux hôpitaux des villes les plus touchées par la pandémie. Dans le même temps, la FDA a mis en garde contre l’utilisation de l’hydroxychloroquine en raison d'effets secondaires graves sur le cœur.
Un standard du traitement du Covid-19
Récemment, un essai randomisé américain, réalisé sur plus de 1 000 malades, a donné des résultats très prometteurs. Il a permis de bloquer la réplication du virus en permettant un rétablissement plus rapide des malades. Il aurait aidé 31% des patients à se rétablir plus rapidement, soit un temps de guérison de 11 jours, contre 15 jours pour ceux ayant reçu un placebo. Ces conclusions n’ont pas encore fait l’objet d’une publication mais lors de sa présentation à la Maison-Blanche, le professeur Anthony Fauci a annoncé que “le remdésivir devrait devenir un standard du traitement de la Covid-19.”