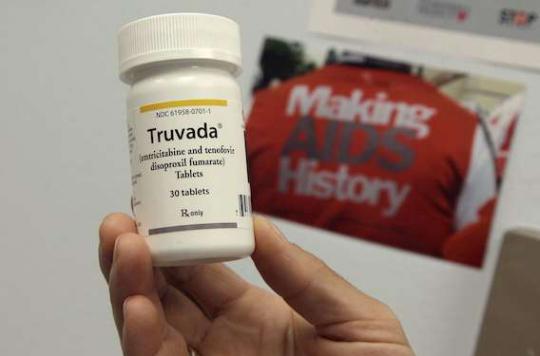
La PrEP n’est plus à l’essai en France. Dans une semaine, le traitement préventif sera homologué comme n’importe quel médicament délivré sur le territoire. En effet, le 28 février, la Recommandation Temporaire d'Utilisation (RTU) du Truvada en prévention du VIH prendra fin. A partir de cette date, le médicament entrera dans le circuit « normal ».
Il faut rappeler ici le parcours de ce traitement préventif qui vise à limiter les nouvelles contaminations par le VIH. Le Truvada est une association de deux inhibiteurs de la transcriptase inverse du VIH (emtricitabine et ténofovir disoproxil fumarate). Depuis 2005, il dispose d’une autorisation de mise sur le marché (AMM) européenne pour le traitement de l’infection par le VIH.
3000 patients dans la RTU
Administré en préventif avant un rapport sexuel à risque (en prophylaxie Pré-exposition, ou PrEP), il permet d’éviter d’être contaminé par le virus. En janvier, la France a mis en place une RTU afin d’offrir ce médicament aux personnes exposées à un haut risque d'infection par voie sexuelle.
La RTU est un dispositif par lequel un médicament n’ayant pas encore d’AMM peut être délivré moyennant une surveillance spécifique et des conditions de prescriptions renforcées. « A ce jour, plus de 3000 personnes ont reçu Truvada dans ce cadre », précise l’Agence du Médicament (ANSM) dans un communiqué.
Aujourd’hui, la RTU ne se justifie plus. Le laboratoire a en effet demandé une extension d’AMM pour le Truvada en PrEP, qu’il a obtenue en août 2016. En annonçant la fin de la RTU, l’ANSM acte donc l’application française de cette extension.
Conditions
Sur le plan pratique, cela signifie que la PrEP pourra désormais être prescrite à toutes les personnes exposées à un haut risque de contamination par le VIH-1 par voie sexuelle. La posologie est d’un comprimé par jour pour le schéma continu (pour le schéma séquentiel : deux comprimés le rapport, un 24 heures après et un autre 48h après). « Le traitement sera initié par un médecin spécialiste hospitalier et/ou exerçant en CeGIDD. Il pourra être renouvelé par le médecin généraliste, dans la limite d’un an, comme c’est actuellement le cas dans le traitement de l’infection par le VIH », précise l’agence.
Le Truvada en PrEP n’est pas dénué d’effets secondaires. L’ANSM rappelle ainsi « le risque de toxicité rénale lié au tenofovir disoproxil fumarate », ainsi que « le risque de séroconversion sous traitement pouvant être associé à l’apparition de mutations de résistance du VIH ». Un suivi régulier, incluant un dépistage du VIH tous les trois mois minimum et une surveillance de la fonction rénale, est ainsi indispensable.
Réduire les risques
Pour veiller au bon déroulement de la prescription et de la prise de ce médicament, l’agence met à disposition des documents de réduction des risques à l’intention des patients et des professionnels de santé (brochure d’information, check-list, carte de rappel des modalités de prise du médicament et des rendez-vous…).
La PrEP s’intègre dans une stratégie de lutte contre le VIH fondée sur de multiples outils. Elle reflète une vision pragmatique et vise à endiguer les nouvelles contaminations, notamment parmi les populations où leur nombre ne diminue pas, ou pas assez. Pour autant, comme le rappelle l’ANSM, cette « stratégie diversifiée » inclut également « notamment la promotion de l’usage du préservatif, qui protège non seulement du VIH mais également des autres infections sexuellement transmissibles »