Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour Une seringue préremplie de 1 mL)
Solution (Composition pour Une seringue préremplie de 1 mL)
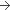 150 mg
150 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 30/08/2023 | Extension d'indication | Le service médical rendu par ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, est important dans lindication de lAMM. |
| Important | Avis du 27/10/2021 | Inscription (CT) | Le service médical rendu par ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, est important dans le traitement de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
| Insuffisant | Avis du 27/10/2021 | Inscription (CT) | Le service médical rendu par ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, est insuffisant pour justifier dune prise en charge par la solidarité nationale chez les patients naïfs de ciclosporine au regard des alternatives disponibles. |
| Important | Avis du 30/08/2023 | Extension d'indication | Le service médical rendu par ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, est important dans lindication de lAMM. |
| Important | Avis du 27/10/2021 | Inscription (CT) | Le service médical rendu par ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, est important dans le traitement de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
| Insuffisant | Avis du 27/10/2021 | Inscription (CT) | Le service médical rendu par ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, est insuffisant pour justifier dune prise en charge par la solidarité nationale chez les patients naïfs de ciclosporine au regard des alternatives disponibles. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 30/08/2023 | Extension d'indication | Compte tenu de : la démonstration de la supériorité du tralokinumab 300 mg toutes les 2 semaines (deux injections dADTRALZA 150 mg) en injection sous-cutanée versus placebo dans une étude de phase III (ECZTRA 6) de bonne qualité méthodologique, en termes de réduction de la sévérité de la maladie (réponses IGA 0 ou 1, EASI 75) et du prurit (réponse prurit NRS = 4), avec une quantité deffet cliniquement pertinente, chez des adolescents à partir de 12 ans ayant une dermatite atopique modérée à sévère qui nécessite un traitement systémique, la démonstration de la supériorité du tralokinumab 300 mg toutes les 2 semaines versus placebo en termes de qualité de vie (score CDLQI) mais avec une quantité deffet non cliniquement pertinente, des résultats à la semaine 72 de létude dextension (ECZTEND) montrant le maintien, voire une amélioration, des réponses cliniques observées à linclusion dans cette étude, chez des patients traités par 300 mg de tralokinumab toutes les 2 semaines, dune toléra |
|
| V (Inexistant) | Avis du 27/10/2021 | Inscription (CT) | ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, napporte pas damélioration du service médical rendu (ASMR V) par rapport à la prise en charge de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
| Avis du 30/08/2023 | Extension d'indication | Compte tenu de : la démonstration de la supériorité du tralokinumab 300 mg toutes les 2 semaines (deux injections dADTRALZA 150 mg) en injection sous-cutanée versus placebo dans une étude de phase III (ECZTRA 6) de bonne qualité méthodologique, en termes de réduction de la sévérité de la maladie (réponses IGA 0 ou 1, EASI 75) et du prurit (réponse prurit NRS = 4), avec une quantité deffet cliniquement pertinente, chez des adolescents à partir de 12 ans ayant une dermatite atopique modérée à sévère qui nécessite un traitement systémique, la démonstration de la supériorité du tralokinumab 300 mg toutes les 2 semaines versus placebo en termes de qualité de vie (score CDLQI) mais avec une quantité deffet non cliniquement pertinente, des résultats à la semaine 72 de létude dextension (ECZTEND) montrant le maintien, voire une amélioration, des réponses cliniques observées à linclusion dans cette étude, chez des patients traités par 300 mg de tralokinumab toutes les 2 semaines, dune toléra |
|
| V (Inexistant) | Avis du 27/10/2021 | Inscription (CT) | ADTRALZA 150 mg (tralokinumab), solution injectable en seringue préremplie, napporte pas damélioration du service médical rendu (ASMR V) par rapport à la prise en charge de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |