Les utilisatrices de contraception orale vont devoir vérifier leur armoire à pharmacie. Plusieurs lots de la pilule Diamilla 75 microgrammes sont rappelés par son fabricant, Arrow Génériques. L’annonce émane de l’Agence nationale de sécurité du médicament (ANSM). 6 lots sont concernés au total. Ce rappel est une mesure de précaution. Il « fait suite à des résultats non conformes observés lors des études de stabilité », précise l’ANSM.
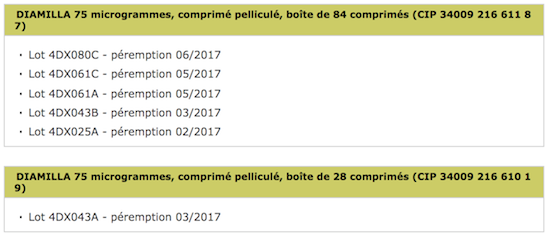
Source : ANSM
La pilule en question est un générique qui s’appuie sur un progestatif seul. Les anomalies relevées sont, pour le moment, sans conséquence. Aucun effet indésirable lié aux résultats n’a été signalé.
Qu’est-ce qu’un essai de stabilité ?
Les essais de stabilité mentionnés par l’ANSM font partie des éléments nécessaires à la mise sur le marché d’un médicament. Ils remplissent un objectif principal : savoir comment le produit final, ou son principe actif, évolue en fonction de divers paramètres. Température ambiante, humidité de l’air, exposition à la lumière sont autant de facteurs qui entrent en compte. Ces études doivent donc tenir compte de la zone où la commercialisation est prévue.
Ces résultats sont importants : ils déterminent la durée de vie d’une médicament – indiquée sur la date « de péremption » inscrite sur les emballages. Ils vont aussi influencer les conditions de stockage recommandées sur la notice. Le non respect de ces règles peut affecter l’efficacité du médicament.
Des règles strictes
L’Organisation Mondiale de la Santé (OMS) a fixé plusieurs règles concernant la conduite de ces études. Une première doit être réalisée préalablement à la mise sur le marché. « Des échantillons sont prélevés sur deux lots de production différents lorsque les principes actifs sont relativement stables », précise l’agence sanitaire de l’ONU.
Mais les études doivent aussi être reproduites à intervalles réguliers : pour les médicaments considérés comme stables, tous les deux ans ; tous les trois à cinq ans pour les principes dont la stabilité est établie. En cas de modification des conditions de production ou de la composition, les compteurs sont remis à zéro.