Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Comprimé (Composition pour Un comprimé)
Comprimé (Composition pour Un comprimé)
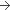 15 mg
15 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 25/10/2023 | Réévaluation SMR et ASMR | Le service médical rendu par RINVOQ 15 mg et 30 mg (upadacitinib), comprimé pelliculé, reste important dans le traitement de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine ainsi que chez ladolescent dans lindication de lAMM. |
| Insuffisant | Avis du 25/10/2023 | Réévaluation SMR et ASMR | INSUFFISANT pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans le traitement de la dermatite atopique modérée à sévère de ladulte en échec des traitements topiques et naïf de ciclosporine, faute de données comparatives |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu par RINVOQ (upadacitinib) est important uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un ou plusieurs DMARD dont au moins un anti-TNF. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique, le service médical rendu par RINVOQ (upadacitinib) est important, en monothérapie ou en association au MTX, uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un ou plusieurs DMARD dont au moins un anti-TNF. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique, le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans la spondylarthrite ankylosante, le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans la spondyloarthrite axiale non radiographique, le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Modéré | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans la spondylarthrite ankylosante, le service médical rendu par RINVOQ (upadacitinib) est modéré uniquement chez les patients ayant une intolérance ou une réponse inadéquate à au moins un anti-TNF. Dans la spondyloarthrite axiale non radiographique, le service médical rendu par RINVOQ (upadacitinib) est modéré uniquement chez les patients ayant une intolérance ou une réponse inadéquate à au moins un anti-TNF. |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu est important pour RINVOQ (upadacitinib) dans le traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, une perte de réponse ou une intolérance aux traitements conventionnels, à au moins un anti-TNFa et au védolizumab, et lorsque les alternatives sont moins appropriées. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu est insuffisant pour RINVOQ (upadacitinib) pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Important | Avis du 29/11/2023 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) 15 mg, 30 mg et 45 mg, comprimé à libération prolongée est important dans le traitement de la maladie de Crohn active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, une perte de réponse ou une intolérance aux traitements conventionnels et à au moins un anti-TNFa, et lorsque les alternatives sont moins appropriées. |
| Insuffisant | Avis du 29/11/2023 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) 15 mg, 30 mg et 45 mg, comprimé à libération prolongée est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Modéré | Avis du 09/11/2022 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) est modéré dans lindication de lAMM. |
| Important | Avis du 04/01/2023 | Extension d'indication | le service médical rendu par RINVOQ (upadacitinib) est important uniquement dans le traitement de la RCH active modérée à sévère chez les patients adultes qui ont présenté une réponse inadéquate, une perte de réponse ou une intolérance, aux traitements conventionnels, à au moins un anti-TNFa et au védolizumab. |
| Important | Avis du 15/12/2021 | Inscription (CT) | Aussi, le service médical rendu par RINVOQ (upadacitinib) 15 mg, comprimé à libération prolongée, est important chez ladolescent âgé de 12 ans et plus qui nécessite un traitement systémique. |
| Important | Avis du 15/12/2021 | Inscription (CT) | La Commission considère que le service médical rendu par RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée est important dans le traitement de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
| Insuffisant | Avis du 15/12/2021 | Inscription (CT) | La Commission considère que le service médical rendu par RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans le traitement de la dermatite atopique modérée à sévère de ladulte en échec des traitements topiques et naïf de ciclosporine, faute de données comparatives. |
| Important | Avis du 19/05/2021 | Extension d'indication | Le service médical rendu par RINVOQ 15 mg (upadacitinib) comprimé à libération prolongée est important dans la nouvelle indication de lAMM. |
| Faible | Avis du 05/05/2021 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) est faible dans la nouvelle indication de lAMM. |
| Important | Avis du 22/04/2020 | Inscription (CT) | Le service médical rendu par RINVOQ (upadacitinib) est important dans lindication de lAMM. |
| Important | Avis du 25/10/2023 | Réévaluation SMR et ASMR | Le service médical rendu par RINVOQ 15 mg et 30 mg (upadacitinib), comprimé pelliculé, reste important dans le traitement de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine ainsi que chez ladolescent dans lindication de lAMM. |
| Insuffisant | Avis du 25/10/2023 | Réévaluation SMR et ASMR | INSUFFISANT pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans le traitement de la dermatite atopique modérée à sévère de ladulte en échec des traitements topiques et naïf de ciclosporine, faute de données comparatives |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu par RINVOQ (upadacitinib) est important uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un ou plusieurs DMARD dont au moins un anti-TNF. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique, le service médical rendu par RINVOQ (upadacitinib) est important, en monothérapie ou en association au MTX, uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un ou plusieurs DMARD dont au moins un anti-TNF. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique, le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans la spondylarthrite ankylosante, le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans la spondyloarthrite axiale non radiographique, le service médical rendu par RINVOQ (upadacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Modéré | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans la spondylarthrite ankylosante, le service médical rendu par RINVOQ (upadacitinib) est modéré uniquement chez les patients ayant une intolérance ou une réponse inadéquate à au moins un anti-TNF. Dans la spondyloarthrite axiale non radiographique, le service médical rendu par RINVOQ (upadacitinib) est modéré uniquement chez les patients ayant une intolérance ou une réponse inadéquate à au moins un anti-TNF. |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu est important pour RINVOQ (upadacitinib) dans le traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, une perte de réponse ou une intolérance aux traitements conventionnels, à au moins un anti-TNFa et au védolizumab, et lorsque les alternatives sont moins appropriées. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu est insuffisant pour RINVOQ (upadacitinib) pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Important | Avis du 29/11/2023 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) 15 mg, 30 mg et 45 mg, comprimé à libération prolongée est important dans le traitement de la maladie de Crohn active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, une perte de réponse ou une intolérance aux traitements conventionnels et à au moins un anti-TNFa, et lorsque les alternatives sont moins appropriées. |
| Insuffisant | Avis du 29/11/2023 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) 15 mg, 30 mg et 45 mg, comprimé à libération prolongée est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Modéré | Avis du 09/11/2022 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) est modéré dans lindication de lAMM. |
| Important | Avis du 04/01/2023 | Extension d'indication | le service médical rendu par RINVOQ (upadacitinib) est important uniquement dans le traitement de la RCH active modérée à sévère chez les patients adultes qui ont présenté une réponse inadéquate, une perte de réponse ou une intolérance, aux traitements conventionnels, à au moins un anti-TNFa et au védolizumab. |
| Important | Avis du 15/12/2021 | Inscription (CT) | Aussi, le service médical rendu par RINVOQ (upadacitinib) 15 mg, comprimé à libération prolongée, est important chez ladolescent âgé de 12 ans et plus qui nécessite un traitement systémique. |
| Important | Avis du 15/12/2021 | Inscription (CT) | La Commission considère que le service médical rendu par RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée est important dans le traitement de la dermatite atopique modérée à sévère de ladulte qui nécessite un traitement systémique, en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
| Insuffisant | Avis du 15/12/2021 | Inscription (CT) | La Commission considère que le service médical rendu par RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans le traitement de la dermatite atopique modérée à sévère de ladulte en échec des traitements topiques et naïf de ciclosporine, faute de données comparatives. |
| Important | Avis du 19/05/2021 | Extension d'indication | Le service médical rendu par RINVOQ 15 mg (upadacitinib) comprimé à libération prolongée est important dans la nouvelle indication de lAMM. |
| Faible | Avis du 05/05/2021 | Extension d'indication | Le service médical rendu par RINVOQ (upadacitinib) est faible dans la nouvelle indication de lAMM. |
| Important | Avis du 22/04/2020 | Inscription (CT) | Le service médical rendu par RINVOQ (upadacitinib) est important dans lindication de lAMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 25/10/2023 | Réévaluation SMR et ASMR | RINVOQ (upadacitinib) 15 mg, comprimé à libération prolongée, napporte pas damélioration du service médical rendu (ASMR V) dans la prise en charge de la dermatite atopique de ladolescent âgé de 12 ans et plus qui nécessite un traitement systémique, celle-ci comportant DUPIXENT (dupilumab) et ADTRALZA (tralokinumab). |
| Avis du 25/10/2023 | Réévaluation SMR et ASMR | Dans le périmètre de remboursement retenu par la Commission : RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée, apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à DUPIXENT (dupilumab) chez ladulte atteint de dermatite atopique qui nécessite un traitement systémique en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
|
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | En 3ème ligne et plus (après échec dau moins un anti-TNF), compte tenu de labsence de supériorité démontrée robuste et cliniquement pertinente à un comparateur cliniquement pertinent : la Commission considère que RINVOQ (upadacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle qui comprend les comparateurs pertinents cités dans le paragraphe 5.2. |
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique : ASMR V Dans la spondylarthrite ankylosante : ASMR V Dans la spondyloarthrite axiale non radiographique : ASMR V |
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Compte tenu : des nouvelles données cliniques defficacité ne modifiant pas lappréciation de lefficacité en comparaison au placebo . de labsence de données defficacité solides comparant les anti-JAK entre eux ou avec les alternatives médicamenteuses (anti-TNF et védolizumab de 2ème ligne et ustékinumab en 3ème ligne) . de labsence deffets établis sur la qualité de vie au long cours (en dehors de lupadacitinib jusquà 52 semaines versus placebo), sur les complications et le recours à la colectomie . et du profil de tolérance actualisé de la classe des anti-JAK, avec notamment un risque accru de tumeurs, dévénements thromboemboliques veineux ou artériels et dinfections graves, voire de décès, en comparaison aux anti-TNF, et de labsence de données cliniques permettant décarter ces risques en comparaison aux alternatives médicamenteuses . la Commission considère que RINVOQ (upadacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérape |
| V (Inexistant) | Avis du 29/11/2023 | Extension d'indication | Chez les patients en échec des traitements conventionnels (corticoïdes ou immunosuppresseurs) et dau moins un anti-TNF, compte tenu : de la qualité méthodologique de la démonstration de lefficacité de RINVOQ (upadacitinib) dans trois études contrôlées et randomisées versus placebo réalisées chez des patients majoritairement en échec à au moins un anti-TNF, ayant surtout une forme modérée de la maladie de Crohn (MC), de la moindre robustesse de cette démonstration pour le traitement dentretien, de la quantité deffet cliniquement pertinente en comparaison au placebo sur la rémission clinique et la réponse endoscopique à S12 et S52, avec un effet établi sur la qualité de vie à S12 (fatigue et score IBDQ) et à S52 (score IBDQ), mais aussi compte tenu : de labsence dimpact supplémentaire établi avec lupadacitinib (RINVOQ) sur les complications (fistules, sténoses), les manifestations extra-intestinales de la maladie de Crohn et le recours à la chirurgie, des données defficacité |
| V (Inexistant) | Avis du 09/11/2022 | Extension d'indication | Compte tenu : du bénéfice clinique démontré versus placebo dans létude Essai 2 SELECT-AXIS 2 en termes de pourcentage de répondeurs ASAS40 (critère de jugement principal) et sur la majorité des critères de jugement secondaires hiérarchisés notamment de qualité de vie à la semaine 14, mais, de labsence de comparaison aux anti-TNF alors que celle-ci était réalisable, la Commission de la Transparence considère que RINVOQ (upadacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique, chez les patients adultes atteints de spondyloarthrite axiale non radiographique active avec des signes objectifs dinflammation et ayant répondu de manière inadéquate aux anti-inflammatoires non stéroïdiens (AINS). |
| V (Inexistant) | Avis du 04/01/2023 | Extension d'indication | Compte tenu : de la qualité méthodologique des études pivots (contrôlées, randomisées, double-aveugle, choix pertinents des critères de jugement y compris de qualité de vie, taille des effectifs), mais sachant que le choix du placebo est regrettable en particulier chez les patients naïfs de tout traitement biologique, et que lévaluation de lefficacité a été faite dans une population hétérogène regroupant patients naïfs et non naïfs de traitement biologique . de la démonstration de supériorité de lupadacitinib par rapport au placebo, avec une quantité deffet pertinente tant à la phase dinduction quà la phase dentretien . de labsence de démonstration dun effet sur le recours à la colectomie . de labsence de donnée comparative versus les anti-TNFa chez les patients ayant eu une réponse inadéquate à un traitement de fond conventionnel et naïfs anti-TNFa, et versus le védolizumab (ENTYVIO), alors que ces comparaisons étaient possibles . et du profil de tolérance de lupadacitinib . |
| V (Inexistant) | Avis du 15/12/2021 | Inscription (CT) | La Commission considère que RINVOQ (upadacitinib) 15 mg, comprimé à libération prolongée, napporte pas damélioration du service médical rendu (ASMR V) dans la prise en charge de la dermatite atopique de ladolescent âgé de 12 ans et plus qui nécessite un traitement systémique, celle-ci comportant DUPIXENT (dupilumab). |
| Avis du 15/12/2021 | Inscription (CT) | La Commission considère que RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée, apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à DUPIXENT (dupilumab) chez ladulte atteint de dermatite atopique qui nécessite un traitement systémique en cas déchec, dintolérance ou de contre-indication à la ciclosporine. | |
| V (Inexistant) | Avis du 19/05/2021 | Extension d'indication | Compte tenu : de la démonstration de la supériorité de lupadacitinib 15 mg par rapport au placebo en termes de répondeurs ACR20 à S12 (critère de jugement principal), de qualité de vie, de capacité fonctionnelle et dobtention dune activité minimale de la maladie (critères de jugement secondaires hiérarchisés) chez des patients ayant eu une réponse inadéquate à un traitement de fond conventionnel et naïfs danti-TNF, soit en 2ème ligne de traitement de fond (étude SELECT-PsA1) ainsi que chez des patients en échec dau moins un anti-TNF soit en 3ème ligne et plus (étude SELECT-PsA2), de la démonstration dune efficacité sur la destruction articulaire par rapport au placebo uniquement en 2ème ligne de traitement (étude SELECT-PsA1), de la démonstration de la non-infériorité de lupadacitinib 15 mg par rapport à ladalimumab 40 mg (anti-TNF), en termes de taux de réponse ACR20 à S12, chez des patients naïfs de traitements biologiques soit en 2ème ligne de traitement de fond (étude SELECT-PsA1 |
| V (Inexistant) | Avis du 05/05/2021 | Extension d'indication | Compte tenu : de la démonstration de la supériorité de lupadacitinib 15 mg par rapport au placebo en termes de taux de répondeurs ASAS 40 (critère de jugement principal considéré comme pertinent) et sur lactivité de la maladie, la réduction de linflammation au niveau du rachis, lobtention de rémissions partielles et la capacité fonctionnelle rachidienne (critères secondaires hiérarchisés) dans létude SELECT-AXIS 1 menée en double aveugle chez 187 patients atteints de spondylarthrite ankylosante ayant répondu de manière inadéquate aux AINS, de labsence de démonstration de sa supériorité par rapport au placebo en termes de qualité de vie, de labsence de donnée : comparative versus les anti-TNF alors que la comparaison était réalisable, chez les patients en échec dun traitement biologique (soit en 3ème ligne et plus), et des inquiétudes en termes de tolérance à long terme, portant en particulier sur les risques infectieux et les risques potentiels cardiovasculaires et carci |
| V (Inexistant) | Avis du 22/04/2020 | Inscription (CT) | Prenant en compte : la non-infériorité de RINVOQ (upadacitinib) en association au méthotrexate (MTX) par rapport à ladalimumab (HUMIRA) en association au MTX en 2ème ligne de traitement cest-à-dire après échec du MTX, sur lobtention dune faible activité de la maladie (score DAS28 = 3,2), labsence de comparaison aux alternatives disponibles en 3ème ligne (notamment les autres anti-TNF, les anti-IL6, labatacept et le rituximab), et les inquiétudes en termes de tolérance à long terme, portant en particulier sur les risques infectieux et les risques potentiels cardiovasculaires et carcinogènes, la commission de la Transparence considère que RINVOQ napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge de la polyarthrite rhumatoïde active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, ou une intolérance, à un ou plusieurs traitements de fond. La stratégie thérapeutique de prise en charge la polyarthrite rhumatoïd |
| V (Inexistant) | Avis du 25/10/2023 | Réévaluation SMR et ASMR | RINVOQ (upadacitinib) 15 mg, comprimé à libération prolongée, napporte pas damélioration du service médical rendu (ASMR V) dans la prise en charge de la dermatite atopique de ladolescent âgé de 12 ans et plus qui nécessite un traitement systémique, celle-ci comportant DUPIXENT (dupilumab) et ADTRALZA (tralokinumab). |
| Avis du 25/10/2023 | Réévaluation SMR et ASMR | Dans le périmètre de remboursement retenu par la Commission : RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée, apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à DUPIXENT (dupilumab) chez ladulte atteint de dermatite atopique qui nécessite un traitement systémique en cas déchec, dintolérance ou de contre-indication à la ciclosporine. |
|
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | En 3ème ligne et plus (après échec dau moins un anti-TNF), compte tenu de labsence de supériorité démontrée robuste et cliniquement pertinente à un comparateur cliniquement pertinent : la Commission considère que RINVOQ (upadacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle qui comprend les comparateurs pertinents cités dans le paragraphe 5.2. |
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique : ASMR V Dans la spondylarthrite ankylosante : ASMR V Dans la spondyloarthrite axiale non radiographique : ASMR V |
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Compte tenu : des nouvelles données cliniques defficacité ne modifiant pas lappréciation de lefficacité en comparaison au placebo . de labsence de données defficacité solides comparant les anti-JAK entre eux ou avec les alternatives médicamenteuses (anti-TNF et védolizumab de 2ème ligne et ustékinumab en 3ème ligne) . de labsence deffets établis sur la qualité de vie au long cours (en dehors de lupadacitinib jusquà 52 semaines versus placebo), sur les complications et le recours à la colectomie . et du profil de tolérance actualisé de la classe des anti-JAK, avec notamment un risque accru de tumeurs, dévénements thromboemboliques veineux ou artériels et dinfections graves, voire de décès, en comparaison aux anti-TNF, et de labsence de données cliniques permettant décarter ces risques en comparaison aux alternatives médicamenteuses . la Commission considère que RINVOQ (upadacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérape |
| V (Inexistant) | Avis du 29/11/2023 | Extension d'indication | Chez les patients en échec des traitements conventionnels (corticoïdes ou immunosuppresseurs) et dau moins un anti-TNF, compte tenu : de la qualité méthodologique de la démonstration de lefficacité de RINVOQ (upadacitinib) dans trois études contrôlées et randomisées versus placebo réalisées chez des patients majoritairement en échec à au moins un anti-TNF, ayant surtout une forme modérée de la maladie de Crohn (MC), de la moindre robustesse de cette démonstration pour le traitement dentretien, de la quantité deffet cliniquement pertinente en comparaison au placebo sur la rémission clinique et la réponse endoscopique à S12 et S52, avec un effet établi sur la qualité de vie à S12 (fatigue et score IBDQ) et à S52 (score IBDQ), mais aussi compte tenu : de labsence dimpact supplémentaire établi avec lupadacitinib (RINVOQ) sur les complications (fistules, sténoses), les manifestations extra-intestinales de la maladie de Crohn et le recours à la chirurgie, des données defficacité |
| V (Inexistant) | Avis du 09/11/2022 | Extension d'indication | Compte tenu : du bénéfice clinique démontré versus placebo dans létude Essai 2 SELECT-AXIS 2 en termes de pourcentage de répondeurs ASAS40 (critère de jugement principal) et sur la majorité des critères de jugement secondaires hiérarchisés notamment de qualité de vie à la semaine 14, mais, de labsence de comparaison aux anti-TNF alors que celle-ci était réalisable, la Commission de la Transparence considère que RINVOQ (upadacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique, chez les patients adultes atteints de spondyloarthrite axiale non radiographique active avec des signes objectifs dinflammation et ayant répondu de manière inadéquate aux anti-inflammatoires non stéroïdiens (AINS). |
| V (Inexistant) | Avis du 04/01/2023 | Extension d'indication | Compte tenu : de la qualité méthodologique des études pivots (contrôlées, randomisées, double-aveugle, choix pertinents des critères de jugement y compris de qualité de vie, taille des effectifs), mais sachant que le choix du placebo est regrettable en particulier chez les patients naïfs de tout traitement biologique, et que lévaluation de lefficacité a été faite dans une population hétérogène regroupant patients naïfs et non naïfs de traitement biologique . de la démonstration de supériorité de lupadacitinib par rapport au placebo, avec une quantité deffet pertinente tant à la phase dinduction quà la phase dentretien . de labsence de démonstration dun effet sur le recours à la colectomie . de labsence de donnée comparative versus les anti-TNFa chez les patients ayant eu une réponse inadéquate à un traitement de fond conventionnel et naïfs anti-TNFa, et versus le védolizumab (ENTYVIO), alors que ces comparaisons étaient possibles . et du profil de tolérance de lupadacitinib . |
| V (Inexistant) | Avis du 15/12/2021 | Inscription (CT) | La Commission considère que RINVOQ (upadacitinib) 15 mg, comprimé à libération prolongée, napporte pas damélioration du service médical rendu (ASMR V) dans la prise en charge de la dermatite atopique de ladolescent âgé de 12 ans et plus qui nécessite un traitement systémique, celle-ci comportant DUPIXENT (dupilumab). |
| Avis du 15/12/2021 | Inscription (CT) | La Commission considère que RINVOQ (upadacitinib) 15 mg et 30 mg, comprimé à libération prolongée, apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à DUPIXENT (dupilumab) chez ladulte atteint de dermatite atopique qui nécessite un traitement systémique en cas déchec, dintolérance ou de contre-indication à la ciclosporine. | |
| V (Inexistant) | Avis du 19/05/2021 | Extension d'indication | Compte tenu : de la démonstration de la supériorité de lupadacitinib 15 mg par rapport au placebo en termes de répondeurs ACR20 à S12 (critère de jugement principal), de qualité de vie, de capacité fonctionnelle et dobtention dune activité minimale de la maladie (critères de jugement secondaires hiérarchisés) chez des patients ayant eu une réponse inadéquate à un traitement de fond conventionnel et naïfs danti-TNF, soit en 2ème ligne de traitement de fond (étude SELECT-PsA1) ainsi que chez des patients en échec dau moins un anti-TNF soit en 3ème ligne et plus (étude SELECT-PsA2), de la démonstration dune efficacité sur la destruction articulaire par rapport au placebo uniquement en 2ème ligne de traitement (étude SELECT-PsA1), de la démonstration de la non-infériorité de lupadacitinib 15 mg par rapport à ladalimumab 40 mg (anti-TNF), en termes de taux de réponse ACR20 à S12, chez des patients naïfs de traitements biologiques soit en 2ème ligne de traitement de fond (étude SELECT-PsA1 |
| V (Inexistant) | Avis du 05/05/2021 | Extension d'indication | Compte tenu : de la démonstration de la supériorité de lupadacitinib 15 mg par rapport au placebo en termes de taux de répondeurs ASAS 40 (critère de jugement principal considéré comme pertinent) et sur lactivité de la maladie, la réduction de linflammation au niveau du rachis, lobtention de rémissions partielles et la capacité fonctionnelle rachidienne (critères secondaires hiérarchisés) dans létude SELECT-AXIS 1 menée en double aveugle chez 187 patients atteints de spondylarthrite ankylosante ayant répondu de manière inadéquate aux AINS, de labsence de démonstration de sa supériorité par rapport au placebo en termes de qualité de vie, de labsence de donnée : comparative versus les anti-TNF alors que la comparaison était réalisable, chez les patients en échec dun traitement biologique (soit en 3ème ligne et plus), et des inquiétudes en termes de tolérance à long terme, portant en particulier sur les risques infectieux et les risques potentiels cardiovasculaires et carci |
| V (Inexistant) | Avis du 22/04/2020 | Inscription (CT) | Prenant en compte : la non-infériorité de RINVOQ (upadacitinib) en association au méthotrexate (MTX) par rapport à ladalimumab (HUMIRA) en association au MTX en 2ème ligne de traitement cest-à-dire après échec du MTX, sur lobtention dune faible activité de la maladie (score DAS28 = 3,2), labsence de comparaison aux alternatives disponibles en 3ème ligne (notamment les autres anti-TNF, les anti-IL6, labatacept et le rituximab), et les inquiétudes en termes de tolérance à long terme, portant en particulier sur les risques infectieux et les risques potentiels cardiovasculaires et carcinogènes, la commission de la Transparence considère que RINVOQ napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge de la polyarthrite rhumatoïde active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, ou une intolérance, à un ou plusieurs traitements de fond. La stratégie thérapeutique de prise en charge la polyarthrite rhumatoïd |