Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Poudre (Composition pour Un flacon)
Poudre (Composition pour Un flacon)
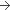 2 mg
2 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est important uniquement dans le traitement de linfection chronique par le virus de lhépatite delta (VHD) chez les patients adultes ayant une maladie hépatique compensée testés positifs pour la présence dARN du VHD dans le plasma (ou le sérum), en association à un traitement de fond contre le VHB et en cas déchec ou dintolérance ou de contre-indication à linterféron alpha pégylé. |
| Insuffisant | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les autres situations incluant notamment la monothérapie par bulévirtide. |
| Important | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est important uniquement dans le traitement de linfection chronique par le virus de lhépatite delta (VHD) chez les patients adultes ayant une maladie hépatique compensée testés positifs pour la présence dARN du VHD dans le plasma (ou le sérum), en association à un traitement de fond contre le VHB et en cas déchec ou dintolérance ou de contre-indication à linterféron alpha pégylé. |
| Insuffisant | Avis du 16/12/2020 | Inscription (CT) | Le service médical rendu par HEPCLUDEX (bulévirtide) est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les autres situations incluant notamment la monothérapie par bulévirtide. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 16/12/2020 | Inscription (CT) | Compte tenu : de la démonstration de son efficacité virologique contre le VHD, en co-administration avec un analogue nucléosidique/nucléotidique actif contre le VHB, chez des patients en échec ou intolérants à linterféron alpha pégylé (réduction dau moins 2 log ou négativation de la charge virale chez environ 50% des patients à 24 semaines, mais avec une charge virale indétectable chez seulement 4 %), de la réponse combinée (réponse virologique et normalisation des ALAT) chez seulement 20 % des patients à 24 semaines, de limpact attendu du contrôle virologique sur lévolution clinique de la maladie, du profil de tolérance acceptable à court terme, du besoin médical important chez les patients en échec ou intolérants à linterféron alpha pégylé et en labsence dalternative dans cette situation, et malgré : des données cliniques préliminaires (2 études de phase II) et, le faible recul en termes de maintien de lefficacité, dimpact sur la réduction de la morbi-mortalité |
|
| Avis du 16/12/2020 | Inscription (CT) | Compte tenu : de la démonstration de son efficacité virologique contre le VHD, en co-administration avec un analogue nucléosidique/nucléotidique actif contre le VHB, chez des patients en échec ou intolérants à linterféron alpha pégylé (réduction dau moins 2 log ou négativation de la charge virale chez environ 50% des patients à 24 semaines, mais avec une charge virale indétectable chez seulement 4 %), de la réponse combinée (réponse virologique et normalisation des ALAT) chez seulement 20 % des patients à 24 semaines, de limpact attendu du contrôle virologique sur lévolution clinique de la maladie, du profil de tolérance acceptable à court terme, du besoin médical important chez les patients en échec ou intolérants à linterféron alpha pégylé et en labsence dalternative dans cette situation, et malgré : des données cliniques préliminaires (2 études de phase II) et, le faible recul en termes de maintien de lefficacité, dimpact sur la réduction de la morbi-mortalité |