Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Gélule (Composition pour Une gélule)
Gélule (Composition pour Une gélule)
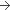 100
100
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 25/09/2024 | Réévaluation SMR et ASMR | Le service médical rendu par INREBIC (fédratinib), 100 mg, gélule, reste modéré dans le traitement de la splénomégalie ou des symptômes liés à la maladie chez les patients adultes atteints de myélofibrose primitive, de myélofibrose secondaire à une polyglobulie de Vaquez ou une thrombocytémie essentielle qui ont été traités par ruxolitinib. |
| Modéré | Avis du 15/12/2021 | Inscription (CT) | Le service médical rendu par INREBIC (fédratinib) est modéré dans le traitement de la splénomégalie ou des symptômes liés à la maladie chez les patients adultes atteints de myélofibrose primitive, de myélofibrose secondaire à une polyglobulie de Vaquez ou une thrombocytémie essentielle chez les patients qui ont été traités par ruxolitinib. |
| Modéré | Avis du 25/09/2024 | Réévaluation SMR et ASMR | Le service médical rendu par INREBIC (fédratinib), 100 mg, gélule, reste modéré dans le traitement de la splénomégalie ou des symptômes liés à la maladie chez les patients adultes atteints de myélofibrose primitive, de myélofibrose secondaire à une polyglobulie de Vaquez ou une thrombocytémie essentielle qui ont été traités par ruxolitinib. |
| Modéré | Avis du 15/12/2021 | Inscription (CT) | Le service médical rendu par INREBIC (fédratinib) est modéré dans le traitement de la splénomégalie ou des symptômes liés à la maladie chez les patients adultes atteints de myélofibrose primitive, de myélofibrose secondaire à une polyglobulie de Vaquez ou une thrombocytémie essentielle chez les patients qui ont été traités par ruxolitinib. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 25/09/2024 | Réévaluation SMR et ASMR | Compte tenu : dune démonstration dune supériorité de fédratinib par rapport au « meilleur traitement disponible » (MTD) chez des patients précédemment traités par ruxolitinib, en termes de réduction >= 35 % du volume splénique dans l'étude FREEDOM-2, avec une différence statistiquement significative de 29,6 % (IC95% = [19,9 . 39,4], p<0,0001, population ITT) entre les deux groupes, à la fin du cycle 6 par rapport à linclusion, dune démonstration dune supériorité de fédratinib par rapport au MTD chez des patients précédemment traités par ruxolitinib, sur le pourcentage de patients ayant une réduction dau moins 50 % du score total des symptômes selon le questionnaire MFSAF, à la fin du cycle 6 par rapport à linclusion, avec une différence statistiquement significative de 17,1 % (IC95% =[4,8 . 29,4], p=0,0033, population ITT) entre les deux groupes, mais : du profil de tolérance dINREBIC (fédratinib) marqué par des événements indésirables gastro-intestinaux, hématologiques (anémies, t |
| V (Inexistant) | Avis du 15/12/2021 | Inscription (CT) | Compte-tenu : de la démonstration de la supériorité dINREBIC (fédratinib) en comparaison au placebo en termes de taux de réponse splénique (RS35%) avec une différence absolue de 35,4 % en faveur du fédratinib 400 mg (p < 0,0001 . IC97,5% [24,2 . 46,7]), Mais : de labsence de démonstration dune amélioration de la survie globale ou de la survie sans progression, des données disponibles sur la qualité de vie à caractère exploratoire ne permettant pas de conclure sur ce critère, du profil de tolérance dINREBIC (fédratinib) marqué par des évènements indésirables gastro-intestinaux, hématologiques (anémies, thrombopénies) et la survenue de cas potentiels graves dencéphalopathie de Wernicke au cours des études toutefois à une posologie supérieure à celle recommandée dans lindication, de labsence de données comparatives versus JAKAVI (ruxolitinib, comparateur cliniquement pertinent) mais tenant compte du développement concomitant nayant pas permis la réalisation dune telle |
| V (Inexistant) | Avis du 25/09/2024 | Réévaluation SMR et ASMR | Compte tenu : dune démonstration dune supériorité de fédratinib par rapport au « meilleur traitement disponible » (MTD) chez des patients précédemment traités par ruxolitinib, en termes de réduction >= 35 % du volume splénique dans l'étude FREEDOM-2, avec une différence statistiquement significative de 29,6 % (IC95% = [19,9 . 39,4], p<0,0001, population ITT) entre les deux groupes, à la fin du cycle 6 par rapport à linclusion, dune démonstration dune supériorité de fédratinib par rapport au MTD chez des patients précédemment traités par ruxolitinib, sur le pourcentage de patients ayant une réduction dau moins 50 % du score total des symptômes selon le questionnaire MFSAF, à la fin du cycle 6 par rapport à linclusion, avec une différence statistiquement significative de 17,1 % (IC95% =[4,8 . 29,4], p=0,0033, population ITT) entre les deux groupes, mais : du profil de tolérance dINREBIC (fédratinib) marqué par des événements indésirables gastro-intestinaux, hématologiques (anémies, t |
| V (Inexistant) | Avis du 15/12/2021 | Inscription (CT) | Compte-tenu : de la démonstration de la supériorité dINREBIC (fédratinib) en comparaison au placebo en termes de taux de réponse splénique (RS35%) avec une différence absolue de 35,4 % en faveur du fédratinib 400 mg (p < 0,0001 . IC97,5% [24,2 . 46,7]), Mais : de labsence de démonstration dune amélioration de la survie globale ou de la survie sans progression, des données disponibles sur la qualité de vie à caractère exploratoire ne permettant pas de conclure sur ce critère, du profil de tolérance dINREBIC (fédratinib) marqué par des évènements indésirables gastro-intestinaux, hématologiques (anémies, thrombopénies) et la survenue de cas potentiels graves dencéphalopathie de Wernicke au cours des études toutefois à une posologie supérieure à celle recommandée dans lindication, de labsence de données comparatives versus JAKAVI (ruxolitinib, comparateur cliniquement pertinent) mais tenant compte du développement concomitant nayant pas permis la réalisation dune telle |