- Le Teizeild (teplizumab), un anticorps monoclonal anti-CD3 développé par Sanofi, a reçu le feu vert de la Commission européenne.
- Ce traitement vise à retarder l'apparition du diabète de type 1 de stade 3 chez les adultes et les enfants de 8 ans et plus atteints d'un diabète de type 1 de stade 2.
- Dans l’étude, menée par le laboratoire, la proportion de patients restés au stade 2 du diabète de type 1 était presque deux fois plus élevée dans le groupe Teizeild que dans le groupe placebo.
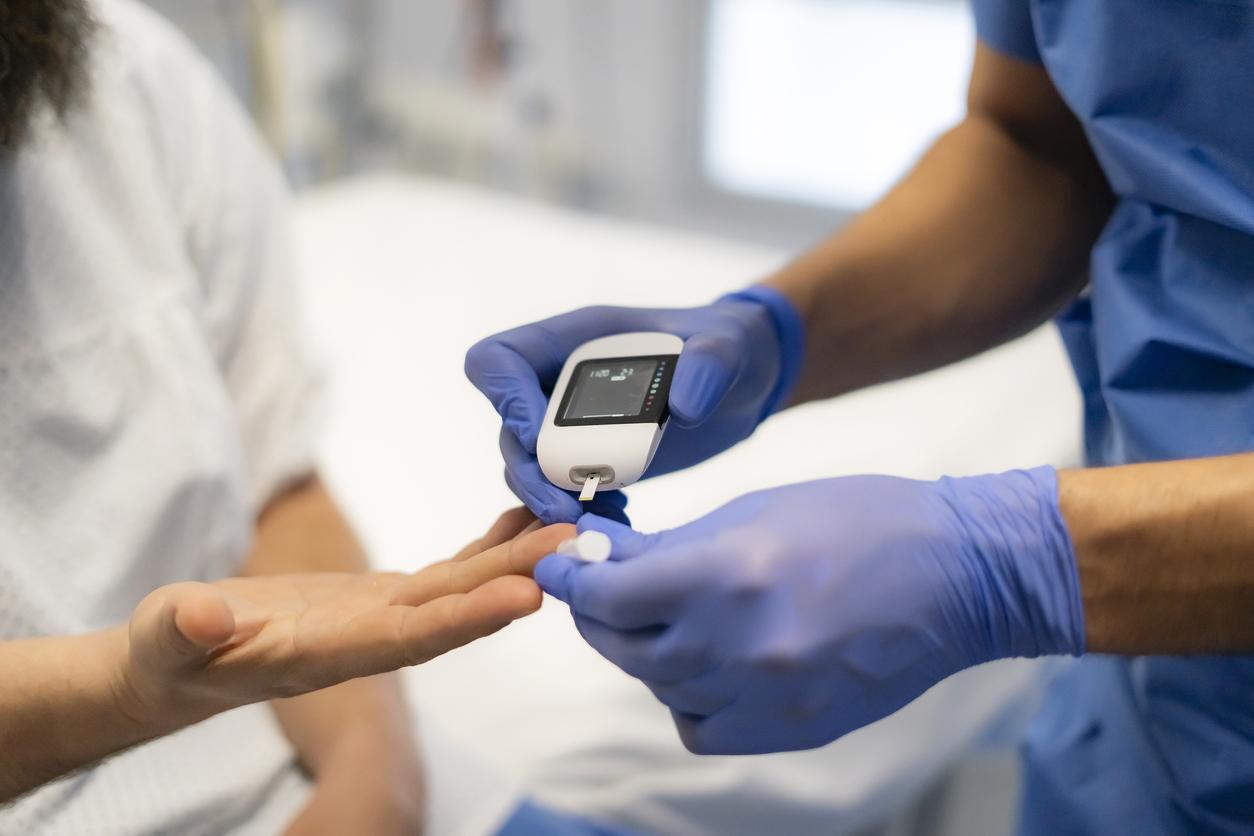
Le 12 janvier, le laboratoire Sanofi s’est félicité d’avoir obtenu l’accord de la Commission européenne pour la commercialisation d’un traitement de fond contre le diabète de type 1, appelé Teizeild (teplizumab). "Cette décision fait suite à l'avis favorable du Comité des médicaments à usage humain de l'Agence européenne des médicaments." Aux États-Unis, au Royaume-Uni, en Chine, au Canada, en Israël, en Arabie saoudite, aux Émirats arabes unis et au Koweït, ce médicament, qui est un anticorps monoclonal anti-CD3, avait déjà eu le feu vert.
Le médicament est indiqué pour les adultes et des enfants de plus de 8 ans atteints de diabète de type 1 de stade 2
Dans un communiqué, le laboratoire précise que le traitement, administré en perfusion, ne guérit pas la maladie, mais agit sur le processus immunitaire sous-jacent au diabète de type 1, c’est-à-dire lorsque le diabète est détectable, mais avant l’arrivée de symptômes. Ce dernier permet de freiner son évolution vers le stade clinique de la maladie, le stade 3, lorsqu'une part importante des cellules bêta est détruite et que des injections d’insuline sont nécessaires pour faire baisser la glycémie. D’après le groupe pharmaceutique, les adultes et des enfants de plus de 8 ans atteints de diabète de type 1 de stade 2 pourront en bénéficier.
Diabète de type 1 : le traitement de fond freine l’évolution de la maladie vers le stade 3
Avant d’approuver la mise sur le marché du traitement dans l’Union européenne, les autorités sanitaires ont examiné les résultats de l’étude TN-10 menée par Sanofi. Dans le cadre des travaux, l'efficacité de Teizeild pour retarder l'apparition du diabète de type 1 de stade 3 chez les personnes diagnostiquées avec un diabète de type 1 de stade 2 (présence d'au moins deux auto-anticorps associés au diabète de type 1 et d'une dysglycémie) a été évaluée. Au total, 76 patients âgés de 8 à 45 ans. Pendant 14 jours, 44 participants ont reçu le Teizeild et 32 ont bénéficié d’un placebo.
Selon les résultats, le délai médian avant le diagnostic de diabète de type 1 de stade 3 était de 48,4 mois dans le groupe Teizeild et de 24,4 mois dans le groupe placebo. La maladie a été diagnostiquée chez 19 volontaires ayant reçu Teizeild et chez 23 de ceux ayant reçu le placebo. "Le profil de sécurité était conforme à celui observé lors des études précédentes menées avec Teizeild. Les effets indésirables les plus fréquemment observés étaient d'ordre hématologique ou médullaire (lymphopénie transitoire) chez 75 % des participants et d'ordre dermatologique ou cutané (éruption cutanée) chez 36 % des participants."