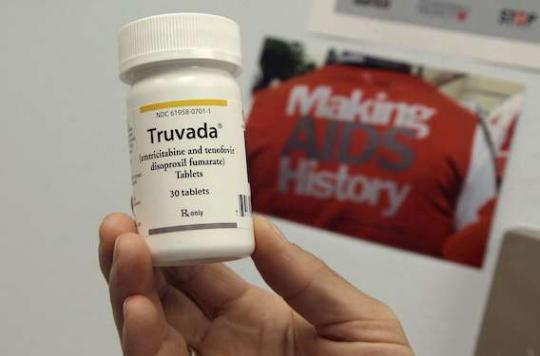
Dans une petite semaine, le Truvada sera disponible dans le traitement préventif du VIH. Ce médicament, conçu pour traiter les infections par le virus, a également montré son efficacité dans la prophylaxie pré-exposition (PreP). Pris avant un rapport sexuel à risque (avec une personne séropositive, par exemple), il permet d’éviter la contamination du partenaire séronégatif.
Le Truvada est actuellement soumis à une RTU (Recommandation Temporaire d’Usage), associée à un suivi et à des conditions de prescriptions strictes. Mais il a obtenu en août 2016 le feu vert des autorités européennes pour un usage en PrEP. La France appliquera cette extension d’AMM ( autorisation de mise sur le marché) dès le 1er mars, date de la fin de la RTU. Toutes les personnes exposées à un haut risque d’infection par voie sexuelle pourront donc se voir prescrire le médicament.
Restent les détails techniques et, notamment, la question cruciale du prix et du remboursement, ainsi que des modalités d’administration. Les négociations sont en cours ; selon nos informations, elles sont âpres. Or, les délais sont serrés puisqu’au 1er mars, il faudra être fixé… Explications.
- Remboursement à 65 %
Le laboratoire Gilead a déposé une demande de remboursement auprès de la Haute Autorité de Santé (HAS). Le 25 janvier 2017, la Commission de Transparence a examiné le dossier. Lors de ces réunions, elle délivre deux notes au médicament : le SMR (Service Médical Rendu) et l’ASMR (Amélioration du Service Médical Rendu). La première prend en compte les qualités intrinsèques du médicament et permet de fixer son taux de remboursement. La seconde est une note relative par rapport aux autres traitements existants et constitue un critère pour fixer le prix du médicament.
Selon nos informations, le SMR du Truvada en PrEP restera inchangé, à savoir, « important » - ce qui implique un taux de remboursement à 65 % par l’Assurance Maladie (soit le maximum pour un médicament). Actuellement, les patients atteints de VIH sont remboursés à 100 % lorsqu’ils sont traités avec du Truvada, puisqu’ils figurent parmi les ALD (affections longue durée). Les personnes qui le prendront dans un cadre préventif devraient, elles, être remboursées à 65 %, sauf si le ministère de la Santé décide d'appliquer une prise en charge intégrale, comme c'est le cas dans la RTU.
- Prix : ça coince
Concernant l’ASMR, la HAS et Gilead ne sont pas encore parvenus à un accord. Le laboratoire demande la meilleure note, ASMR 1, qui lui permettrait de négocier un prix plus élevé par la suite. La HAS, elle, ne concède qu’une ASMR 5, la moins bonne, mais identique à celle du Truvada en traitement curatif du VIH (et obtenue par la majorité des médicaments, étant donné que sur un marché saturé, il est difficile d’innover).
Cette « mauvaise » note peut être liée à l’existence d’alternatives moins toxiques sur le marché, comme le préservatif – le Truvada a en effet une toxicité avérée sur les reins. Par ailleurs, le médicament est déjà disponible en ville, à environ 400 euros les 30 comprimés. Il ne s’agit pas d’une nouvelle molécule, mais d’une extension d’utilisation. Enfin, le nombre de personnes qui pourraient prendre du Truvada est potentiellement élevé – plus, en tout cas, que le nombre de patients VIH traités avec le Truvada. Tous ces éléments peuvent expliquer l’ASMR 5, induisant un prix moins élevé que celui escompté par le laboratoire.
- Quid des délais ?
Gilead n’a plus que quelques heures pour indiquer s’il accepte la note de la HAS ou s’il la conteste. Dans ce cas, une nouvelle audition aura lieu, au cours de laquelle l’industriel présentera ses arguments.
Quand cette procédure sera terminée, le laboratoire aura plusieurs choix. Il pourra refuser définitivement l’avis de la HAS, suspendre son projet de commercialisation en France ou fixer son propre prix sans prétendre à un remboursement – les patients devront alors payer de leur poche. Sinon, le laboratoire peut accepter la note ; le dossier passe alors entre les mains du CEPS, organe chargé de négocier les prix, qui a trois mois pour achever la procédure.
Ce qui nous emmène bien au-delà du 1er mars. Pour éviter une rupture de prise en charge, le ministère de la Santé indique que le dispositif "post-RTU" s'appliquera, à savoir que tant que les négociations ne sont pas achevées, les conditions de la RTU continueront de s'appliquer avec un remboursement à 100 % de la PrEP.
- Prise : 2 schémas validés
Le Truvada en PrEP a obtenu une AMM pour un schéma d’administration continuel (en prise continue). Or, l’étude Ipergay a démontré une efficacité équivalente pour un schéma d’administration séquentiel (prise occasionnelle, avant et après un rapport à risque). Ce schéma, moins onéreux et invasif, n’est théoriquement pas indiqué mais dans les faits, nombreux sont ceux qui l’adopteront.
La ministre de la Santé a donc chargé la HAS de rédiger des fiches de bon usage à destination des médecins prescripteurs et des personnes qui utiliseront le Truvada en PrEP. Ces documents présentent le protocole pour les deux schémas, les précautions, les effets secondaires etc. Ils ont été rédigés et validés ce mercredi. Marisol Touraine doit les recevoir sur son bureau dans les prochaines heures.