Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.

Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour Une seringue préremplie de 1 mL de solution)
Solution (Composition pour Une seringue préremplie de 1 mL de solution)
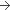 100 mg
100 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 11/07/2022 | Réévaluation SMR et ASMR | Le service médical rendu par TREMFYA (guselkumab) devient important dans lindication de lAMM. |
| Modéré | Avis du 19/05/2021 | Extension d'indication | Le service médical rendu par TREMFYA 100 mg (guselkumab), solution injectable en seringue préremplie et en stylo prérempli est modéré dans la nouvelle indication de lAMM. |
| Important | Avis du 04/03/2020 | Réévaluation ASMR | " Le service médical rendu par TREMFYA 100 mg, solution injectable en seringue préremplie reste important, uniquement dans le traitement du psoriasis en plaques de ladulte, chez les patients ayant un psoriasis en plaques chronique sévère, défini par : - un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie - et une forme étendue et/ou un retentissement psychosocial important. " |
| Insuffisant | Avis du 04/03/2020 | Réévaluation ASMR | Dans les autres formes, le service médical rendu reste insuffisant pour une prise en charge par la solidarité nationale. |
| Important | Avis du 03/10/2018 | Inscription (CT) | " le service médical rendu par TREMFYA 100 mg, solution injectable en seringue préremplie est important uniquement dans le traitement du psoriasis en plaques de ladulte, chez les patients ayant un psoriasis en plaques chronique sévère, défini par : - un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie - et une forme étendue et/ou un retentissement psychosocial important. " |
| Insuffisant | Avis du 03/10/2018 | Inscription (CT) | Dans les autres formes, le service médical rendu est insuffisant pour une prise en charge par la solidarité nationale. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 11/07/2022 | Réévaluation SMR et ASMR | ASMR IV par rapport à COSENTYX (sécukiumab). | |
| V (Inexistant) | Avis du 19/05/2021 | Extension d'indication | " Compte tenu : - de la supériorité du guselkumab démontrée par rapport au placebo sur la réponse ACR 20 (critère de jugement principal) et sur les réponses ACR 50 et ACR 70 (critères de jugement secondaires hiérarchisés) avec une quantité deffet modérée voir modeste, - dun effet structural démontré versus placebo en tant que critère secondaire hiérarchisé, uniquement chez des patients naïfs de médicaments biologiques et uniquement pour le schéma dadministration toutes les 4 semaines, - dun profil de tolérance conforme au profil connu dans le psoriasis en plaques, marqué principalement par des infections, mais aussi compte tenu dun risque spécifique daugmentation fréquente des transaminases chez les patients traités pour un rhumatisme psoriasique et des risques immunogène et cancérigène à long terme non évalués, - de labsence de comparaison à un traitement actif, notamment un anti-TNF, alors que cette comparaison était réalisable, la Commission de la Transparence considère que TREMFYA 10 |
| Avis du 04/03/2020 | Réévaluation ASMR | " Compte-tenu : - de la démonstration dans une étude de bonne qualité méthodologique de la supériorité du guselkumab par rapport au sécukinumab, comparateur cliniquement pertinent, - dun gain absolu cliniquement pertinent en faveur du guselkumab de 12,4 %, p < 0 ,001) en termes de réponse PASI 90 à S48 chez des patients nécessitant un traitement systémique, - du profil de tolérance du guselkumab comparable dans létude à celui du secukinumab avec toutefois des incertitudes sur sa tolérance à long terme, - dun rythme dadministration allégé par rapport à celui du secukinumab (injection toutes les 8 semaines versus toutes les 4 semaines), TREMFYA100 mg (guselkumab), solution injectable, apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à COSENTYX (secukinumab) dans le traitement du psoriasis en plaques, chez les patients adultes ayant un psoriasis en plaques chronique sévère, défini par : - un échec (réponse insuffisante, contre-indication ou intolérance) à au |
|
| V (Inexistant) | Avis du 03/10/2018 | Inscription (CT) | " Compte tenu : - dune quantité deffet importante versus placebo en termes de disparition complète ou presque complète des lésions (IGA = 0 ou 1) et damélioration des symptômes (réponse PASI 90) après 16 semaines (co-critères de jugement principaux), - de la démonstration dune supériorité par rapport à HUMIRA après 16 semaines sur ces mêmes critères de jugement, - du maintien de la supériorité du guselkumab par rapport au placebo et ladalimumab jusquà la semaine 48, - de labsence de démonstration méthodologiquement recevable dune supériorité du guselkumab par rapport à lustekinumab (STELARA), - de labsence de comparaison directe avec le secukinumab (COSENTYX), lixekizumab (TALTZ) et le brodalumab (KYNTHEUM), - , TREMFYA 100 mg, solution injectable napporte pas damélioration du service médical rendu (ASMR V) par rapport aux autres inhibiteurs dinterleukines chez les adultes ayant un psoriasis en plaques chronique sévère, défini par : - un échec (réponse insuffisante, con |