Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.

Ce médicament n'appartient à aucun groupe générique
 Gélule (Composition pour Une gélule)
Gélule (Composition pour Une gélule)
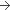 1 mg
1 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 19/02/2020 | Réévaluation SMR et ASMR | Le service médical rendu par IMNOVID reste important dans lindication « en association avec la dexaméthasone, dans le traitement du myélome multiple en rechute et réfractaire chez les patients adultes ayant déjà reçu au moins deux traitements antérieurs comportant le lénalidomide et le bortézomib et dont la maladie a progressé pendant le dernier traitement. » |
| Important | Avis du 19/02/2020 | Extension d'indication | Le service médical rendu par IMNOVID (pomalidomide) est important dans la nouvelle indication de lAMM. |
| Important | Avis du 08/01/2014 | Inscription (CT) | La Commission considère que le service médical rendu par IMNOVID est important dans lindication et à la posologie de lAMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 19/02/2020 | Réévaluation SMR et ASMR | " Compte tenu : des données disponibles avec IMNOVID en association avec la dexaméthasone issues de létude pivot MM-003, déjà évaluées par la Commission, montrant un gain modeste en termes defficacité notamment sur la survie sans progression, par rapport à un comparateur [dexaméthasone à forte dose] devenu non cliniquement pertinent, des nouvelles données defficacité et de tolérance issues dune analyse intermédiaire dune étude observationnelle, non comparative (étude MIROIR), qui suggère une cohérence des résultats avec ceux de létude pivot MM-003 en termes de survie sans progression sous IMNOVID en association avec la dexaméthasone, de labsence de donnée comparative versus les autres traitements désormais disponibles en troisième ligne, de la non transposabilité des résultats de létude de phase III MM-003 et de létude MIROIR aux patients traités selon la prise en charge actuelle en raison de lévolution récente de la stratégie thérapeutique du myélome multiple, du besoin |
| V (Inexistant) | Avis du 19/02/2020 | Extension d'indication | " Compte tenu de : - la supériorité de IMNOVID (pomalidomide) en association au bortézomib et à la dexaméthasone par rapport à cette même association administrée seule, en termes de survie sans progression (gain absolu de 4,1 mois), dans une étude réalisée en ouvert chez des patients en rechute ou réfractaire au lénalidomide, - sans toutefois de gain démontré sur la survie globale, - de labsence de données robustes sur la qualité de vie des patients, - et du besoin médical partiellement couvert, la Commission considère que IMNOVID, en association au bortézomib et à la dexaméthasone, napporte pas damélioration du service médical rendu (ASMR V) par rapport à lassociation bortézomib / dexaméthasone, chez les patients atteints de myélome multiple ayant déjà reçu au moins une ligne de traitement incluant le lénalidomide. " |
| Avis du 08/01/2014 | Inscription (CT) | IMNOVID, en association à la dexaméthasone, apporte une amélioration du service médical rendu modérée (ASMR III) en termes defficacité dans la prise en charge du myélome multiple en rechute et réfractaire, chez les patients adultes ayant déjà reçu au moins deux traitements antérieurs comportant le lénalidomide et le bortézomib, et dont la maladie a progressé pendant le dernier traitement. |