Fin de récréation pour les fabricants de dispositifs médicaux (DM). Souvent décriée pour son laxisme, la législation sur les DM vient d’être considérablement renforcée au niveau européen. « Ces changements, nécessaires pour la sécurité sanitaire et la confiance des professionnels de santé et des patients envers les DM, seront mis en place progressivement », fait savoir l’agence nationale de sécurité du médicament (ANSM) dans un communiqué publié ce mardi.
Deux nouveaux règlements distincts ont ainsi été adoptés, l’un pour les dispositifs médicaux (DM), l’autre pour les dispositifs médicaux de diagnostic in vitro (DMDIV). Ils seront respectivement applicables d’ici trois et cinq ans.
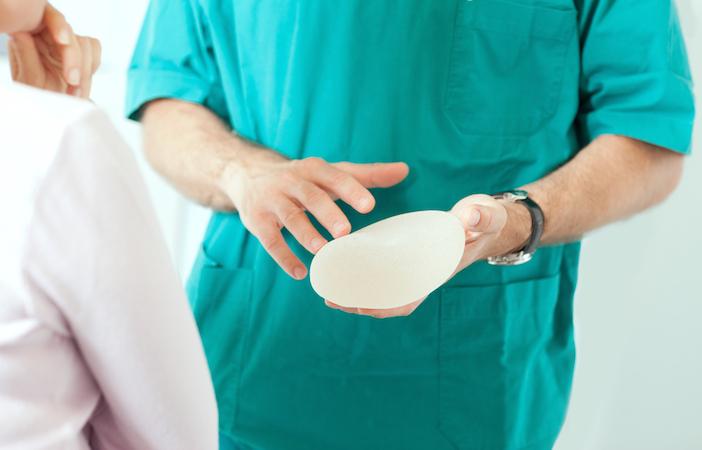
Cette évolution législative très attendue intervient dans un marché considéré comme très peu régulé, ce qui a donné lieu à plusieurs scandales sanitaires – prothèses mammaires PIP, injections anti-rides, Essure… « Cette révision a notamment pour objectif un renforcement de la sécurité sanitaire et une harmonisation des règles applicables aux DM au sein de l’Union européenne. Elle doit également apporter une simplification et une amélioration de leur lisibilité, et doit permettre de mieux s’adapter à l’innovation ».
Des contrôles renforcés
Les nouveaux règlements ont également pour objectif de « renforcer la transparence, faciliter la mise en place d’une gouvernance européenne du secteur des dispositifs médicaux ainsi qu’une meilleure évaluation pré et post mise sur le marché », précise l’agence.
De nouvelles obligations seront imposées aux opérateurs du secteur des dispositifs médicaux. Ainsi, chez les fabricants et les mandataires, une personne sera chargée du respect de la réglementation. Par ailleurs, « des obligations de prudence » seront exigées pour tous les importateurs et distributeurs.
« Les autorités compétentes doivent se doter de capacités d’inspection des opérateurs du secteur », précise l’ANSM. Le cahier des charges sera renforcé en matière de compétence et de contrôles (notamment des visites inopinées chez les fabricants).
Notification des incidents
Par ailleurs, l’Europe va se doter d’une nouvelle base de données européenne, « pour une meilleure connaissance du marché, des incidents et des investigations cliniques » à travers le continent. Chaque DM aura un identifiant unique afin d’améliorer la traçabilité dans la chaine de distribution.
Les incidents liés aux DM devront être notifiés au niveau européen et les fabricants auront l’obligation de produire des « résumés périodiques de sécurité ». « Une véritable régulation du secteur à l’échelon européen sera mise en place à l’aide d’un Groupe de Coordination des autorités nationales en matière de Dispositifs Médicaux (GCDM) dont une des tâches sera de veiller à la coordination des actions de surveillance du marché », peut-on lire.