Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour Un flacon de 0,5 mL)
Solution (Composition pour Un flacon de 0,5 mL)
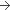 100 microgrammes
100 microgrammes
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 04/01/2023 | Inscription (CT) | Le service médical rendu par KIMMTRAK 100 µg/0,5 mL (tébentafusp), solution à diluer pour perfusion est important dans lindication de lAMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 04/01/2023 | Inscription (CT) | " Compte-tenu : ¿ de la démonstration dans une étude de phase III comparative, randomisée, ouverte de la supériorité du tébentafusp (voie IV) par rapport au traitement comparateur laissé au choix de linvestigateur (pembrolizumab dans 82 % des cas), en traitement de 1ère ligne chez des adultes HLA-A*02 :01-positifs atteints de mélanome uvéal métastatique, en termes de survie globale (SG) avec un gain en médiane de 5,7 mois . mais considérant dautre part : ¿ la supériorité du tébentafusp démontrée par rapport au traitement comparateur laissé au choix de linvestigateur, en termes de survie sans progression (SSP) avec un gain médian de 0,4 mois, non cliniquement pertinent . ¿ le profil de tolérance marqué par les risques importants de survenue, de réactions cutanées aiguës (94 %), de troubles cardiaques (15 %) ou dun syndrome de relargage des cytokines (89 % des patients) nécessitant une surveillance avant et après ladministration du tébentafusp . ¿ labsence de données robustes sur la qualité |