L'Agence Nationale de Sécurité du Médicament (ANSM) veille au grain. Dans un communiqué publié ce mardi, elle a annonce avoir suspendu les Autorisations de mise sur le marché (AMM) de 9 spécialités commercialisées en France, notamment des antipaludiques. Cela « dans l’attente de l’issue de la procédure d’arbitrage européen », précise-t-elle.
Mais ces mesures de suspension, qui ont pris effet hier, sont prises « à titre de précaution », rassure-t-elle. Elle indique, qu'à ce jour, aucun élément n’a conduit à établir un risque avéré pour la santé humaine ou un manque d’efficacité de ces médicaments. Elle ajoute que « ces suspensions ne concernent que des spécialités contenant 3 substances actives (ou association de substances actives) et aucun risque de rupture ou d’interruption de traitement n’est à craindre dans la mesure où ces médicaments sont disponibles sous d’autres marques ».
Des résultats d'essais manipulés
Pour comprendre la publication de cette décision, l'ANSM rappelle que le Comité des médicaments à usage humain (CHMP) de l’Agence européenne des médicaments (EMA) a, lors de sa réunion du mois d’avril 2016, engagé une procédure de réévaluation du rapport bénéfice/risque des spécialités pour lesquelles les études cliniques ont été menées dans le centre privé Semler Research situé à Bangalore en Inde.
Cette revue fait suite à des inspections conduites par la Food and Drug Administration (FDA) des Etats-Unis d’Amérique et l’Organisation Mondiale de la Santé (OMS), qui ont mis en évidence des manipulations des résultats d’essais de bioéquivalence (1) par le remplacement des échantillons biologiques de certains sujets par les échantillons d’autres sujets. « Ces manipulations caractérisent un manque de respect des Bonnes Pratiques Cliniques concernant ces études de bioéquivalence et remettent en cause la fiabilité des résultats de l’ensemble des essais de bioéquivalence conduits par cette société », indique l'ANSM.
Plusieurs lots rappelés
D’autre Etats membres ont également pris des mesures nationales de suspension des AMM des médicaments concernés présents sur leur marché. Cela comme le prévoit la réglementation européenne, dans l’attente de la décision finale de la Commission européenne.
« Les lots de ces produits présents dans les officines, dans les établissements de santé et chez les grossistes répartiteurs font l’objet d’un rappel (voir la liste ci-dessous) », conclut l'ANSM.
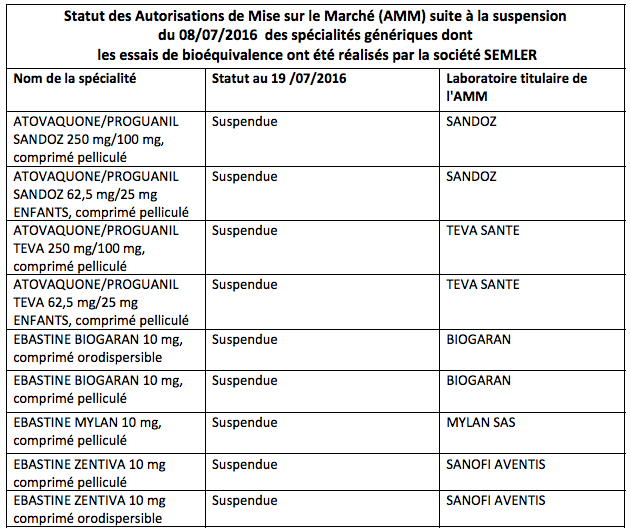
Source : ANSM